동향분석
Home > 뉴스브리핑센터 > 동향분석| [NRF 동향] 20가지 아미노산 이외에 2가지가 더 있다?! |
|
20가지 아미노산 이외에 2가지가 더 있다?! 달걀, 세포막, 머리카락, 콩, 소화효소, 소고기 마지막으로 MSG까지. 이들의 공통점은 무엇일까요? 바로 단백질과 관련이 있습니다. 다이어트를 하시는 분들을 보면 근육량을 늘리기 위해 단백질 셰이크나 달걀, 닭 가슴살 등을 섭취하곤 합니다. 이들에게는 단백질이 매우 풍부하게 포함되어 있으며 콩과 소고기에도 다량 포함되어 있습니다. 머리카락은 단백질의 일종인 케라틴으로 구성되어 있으며, 소화효소 역시 단백질로 구성됩니다. 세포의 외부를 감싸는 세포막은 여러 물질의 수송 역할 등을 도맡는 세포막 단백질이 있습니다. 마지막으로 언급한 MSG는 MonoSodium Glutamate의 약자로 단백질을 구성하는 아미노산 종류 중 하나인 글루탐산(Glutamic acid)에 소듐을 첨가하여 생성한 발효 조미료입니다. 화학조미료가 아니라 발효 조미료인 이유는 미생물을 통해 글루탐산을 생성하고 이후 소듐을 첨가해 최종적인 MSG가 만들어지기 때문입니다. 이처럼 단백질은 우리 주변에서 매우 흔하게 찾아볼 수 있습니다. 적혈구에 들어있으며 붉은 빛을 띠게 하는 이유인 헤모글로빈 역시 단백질입니다.
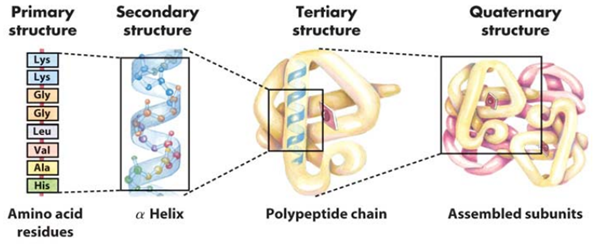
대표적인 단백질이자 4차 구조로 형성된 헤모글로빈 사진 출처: 네이버 생화학 백과 그럼 단백질은 어떻게 구성될까요? 단백질은 총 4단계의 구조로 형성됩니다. 1차 구조는 단백질의 구성 물질인 아미노산이 펩타이드 결합으로 연결되어 폴리펩타이드를 형성합니다. 2차 구조는 아미노산 사이의 작용으로 1차 구조의 폴리펩타이드가 나선형이나 병풍처럼 접힌 모양을 띱니다. 3차 구조는 2차 구조의 폴리펩타이드가 구부러지거나 접혀 입체를 형성하며, 4차 구조는 이렇게 형성된 폴리펩타이드가 2개 이상 모여 복합체가 형성한 것을 의미합니다.
단백질 형성의 4단계 구조: 1차, 2차, 3차, 4차 구조 사진 출처: Brock Biology of Microorganisms 자, 그렇다면 1차 구조에서 확인한 아미노산에 대해 본격적으로 알아보도록 하겠습니다. 아미노산은 단백질을 구성하는 기본 단위입니다. 단백질의 생물학적 기능과 구조는 포함된 아미노산과 그 서열에 의하여 결정됩니다. 아미노산은 각각 다양한 화학적 특성을 나타내는 여러 종류가 있는데요. 그럼 이러한 화학적 특성은 어디에서 나타날까요? 이를 알아보기 위해서는 아미노산의 구조에 대해 이해하여야 합니다.
아미노산의 구조 사진 출처: Brock Biology of Microorganisms α-아미노 카복실산(α-amino carboxylic acid)의 약자로 알파 탄소라 불리는 중심 탄소에 염기성 아미노기(-NH2), 산성 카복실기(-COOH) 및 R기(또는 체인)가 결합하는 구조입니다. R기는 Side Chain으로도 불리며 각 아미노산의 주요 차이점은 R기의 화학적 특성에 따라 결정됩니다. 아래의 그림은 아미노산별 R기의 구조를 보여주고 있습니다. 아래 그림을 보고 계신다면 의문점이 생기실 수 있습니다. 보통 알려진 아미노산의 종류는 20가지인데 아래의 그림에는 2가지의 아미노산이 더 존재하기 때문이죠! 그 주인공은 바로 Selenocysteine과 Pyrrolysine입니다. 이 두 개가 바로 뒤늦게 발견된 2가지의 아미노산입니다.
자연에 존재하는 22가지의 아미노산들 사진 출처: Brock Biology of Microorganisms 자연계에는 22가지의 아미노산이 있지만, 교과서 등의 책에서 설명하는 20가지는 생체 내 단백질 합성에 관여하는 표준 아미노산입니다. 종류로는 글리신, 알라닌, 발린, 류신, 아이소류신, 트레오닌, 세린, 시스테인, 메싸이오닌, 아스파르트산, 아스파라긴, 글루탐산, 글루타민, 라이신, 아르지닌, 히스티딘, 페닐알라닌, 타이로신, 트립토판, 프롤린이 있습니다. 그럼 이처럼 잘 알려진 20가지 외에 2가지는 무엇일까요?
Selenocysteine의 구조 사진 출처: 네이버 생명과학대사전 1974년 발견된 셀레노시스테인(Selenocysteine)은 정규 아미노산인 시스테인의 황 원자(S) 자리에 셀레늄(Se)이 들어간 구조를 가진 천연 아미노산입니다. 셀레노시스테인을 함유한 단백질을 셀레노 단백질이라고 부르는데, 항산화 활성이 있는 효소가 해당 단백질에 속합니다. 사람은 54가지의 셀레노 단백질이 있습니다. 셀레노시스테인은 효소의 활성에 중요한 역할을 하며 방사선 방어작용이나 항암작용을 합니다. 근육의 세렌단백질이나 글루타싸이온 과산화효소, 글리신 환원효소, 폼산 탈수소효소와 같은 효소류의 활성중심에 포함됩니다. 굉장히 특이한 점은 셀레노시스테인이 종결코돈 UGA에 암호화되어있다는 것입니다. 코돈(Codon)이란 특정 아미노산을 결정짓는 mRNA 상의 3개의 염기서열을 의미합니다. 간단히 3가지 조합의 염기서열을 코돈이라 하며 코돈 61가지가 아미노산 20가지를 지정합니다. 3가지 코돈인 UAA, UGA, UAG는 아미노산을 지정하는 대신 단백질 합성을 끝내라는 정보를 담고 있는 ‘종결코돈(termination codon)’입니다. 즉 mRNA에서 UGA 뒤에 특정한 염기서열이 있을 경우 번역이 끝나는 대신 셀레노시스테인이 붙습니다. 다만 셀레노시스테인은 담당 tRNA에 정규 아미노산인 세린(serine)이 붙고 이 상태에서 효소의 작용으로 세린이 셀레노시스테인으로 바뀌는 특징이 있습니다. 따라서 세포질을 자유롭게 떠다닐 수는 없습니다.
Pyrrolysine의 구조 사진 출처: 네이버 미생물학 백과 22번째로 채택된 아미노산은 피롤라이신(pyrrolysine)으로 비교적 최근인 2002년에 메탄생성 고세균인 메타노사르시나(Methanosarcina barkeri)의 단백질에서 발견됐습니다. 사람의 인체에는 존재하지 않으며, 메탄생성 고세균과 세균에서 단백질 생합성에 사용됩니다. α-아미노산 중 하나로, 셀레노시스테인처럼 특이하게도 종결 코돈인 ‘TAG’에 암호화되어있습니다. 해당 종결 코돈은 메탄생성과 관련된 몇몇 효소에서 피롤라이신 코돈으로 작용합니다. 셀레노시스테인과는 달리 피롤라이신은 세포 내에서 만들어져 담당 tRNA에 결합할 수 있습니다. 다소 복잡하지만 알면 알수록 신기하고 드넓은 단백질의 세계! 22가지의 아미노산의 배열을 통해 1차 구조를 형성하고 이후 2, 3, 4차 구조를 형성하는 만큼 자연에 실존하거나 인공적으로 만들어지는 단백질은 수없이 많습니다. 그 광대한 단백질의 세계가 어렴풋이 느껴지시나요? 22번째 아미노산인 피롤라이신이 20년이 채 지나지 않은 2002년에 발견된 만큼, 아직도 발견되지 않은 천연 아미노산이 어딘가에 숨어있을지 모릅니다. 과연 23번째 천연 아미노산은 언제 발견되고 과연 무엇일지 기대를 품으며 이만 글을 마치도록 하겠습니다.
|